- 學期:107-2
- 課程:動物生理學實驗 Animal Physiology Laboratory
- 老師:李昆澤 Kun-Ze Lee
- 主題:動物插管、灌流與生理測量
- 系所:國立中山大學生物科學系
本次使用實驗用活體大鼠,單純用於教學目的,本人對大鼠的犧牲敬上最高的敬意。以下測量實驗為侵入式實驗,故以下有大量血腥慘忍的畫面,請斟酌閱讀。
一、實驗目的
透過老師實際演示以及自己動手操作,學習用腹腔麻醉注射長效型麻醉劑,以及用痛覺測驗來判斷小鼠是否麻醉完全?後續進行動物氣管插管並測量其呼吸流量,以及動脈插管並測量其舒張壓與收縮壓。然後剖開腹腔直達胸腔找到心臟,並從主動脈進行灌流,分別為洗滌、固定與脫水,最後取下實驗部位放置保存劑中保存。二、材料與方法
(一)材料
- 實驗動物:十週齡(74天)雄性SD大鼠/十一週齡(81天)雄性SD大鼠
- 手術用具:手套、手術盒、透氣膠帶、棉花、紗布、手術台、加熱版
- 麻醉用具:針頭、針筒、長效型麻醉劑 (urethane)
- 插管用具:氣插管、動脈插管
- 呼吸測量儀器:呼吸頭、尖峰流速計 (spirometer)
- 血壓測量儀器:傳感器 (transducer)、訊號放大器 (amplifier)
- 灌流試劑:生理食鹽水 (hepa-saline)(洗滌劑)、4 %多聚甲醛 (paraformaldehyde)(固劑)、4 %多聚甲醛的10%蔗糖溶液(脫水固定劑)、30%蔗糖磷酸鹽緩衝生理食鹽水(保存劑)
 |
| 灌流幫浦系統 |
(二)方法
- 麻醉:先將大鼠秤重並依其重量查表找出適當的麻醉劑用量,用針筒取適當麻醉劑用量後,裝上針頭並鬆開針頭蓋。一手從大鼠下半部背後將其固定並將其下腹抬起置適當仰角後,另一手持針筒對準右下腹垂直插入,施予腹腔注射,並靜待約5分鐘後。然後對小鼠進行痛覺測驗,大力按壓其腳趾,如腳趾有縮回反應,則代表需要再施予麻醉劑;反之,則可進行下一步的實驗。
- 術前:麻醉後的大鼠,先將手術部位(頸部與左下腹)剃毛,並將大鼠頭部牙齒與四肢用大頭針或透氣膠帶固定於底下有加熱板的手術台上,再將肛溫計置入大鼠肛門內並打開加熱器以保持大鼠體溫。
- 氣管插管:一手持鑷子,另一手持剪刀,將大鼠頸部皮膚上提並剪開,再剪開氣管上層肌肉找出氣管,並分離氣管與之周圍的肌肉。將棉線由氣管下方穿過,並於氣管近口端與近肺端兩端用棉線分別打鬆活結,並用小剪刀於氣管兩端中剪出一個小洞,再將氣插管由孔洞插入至氣管近肺端,並用兩端的棉線固定氣插管,且蓋上浸泡過生理食鹽水的紗布於切口上。最後在氣插管後端接上呼吸頭與尖峰流速計,並打開機器與軟體,即可及時監控大鼠呼吸流量。
- 動脈插管:一手持鑷子,另一手持剪刀,將大鼠下腹部皮膚上提並剪開,再剪開股動脈上層肌肉找出股動/靜脈,並分離股動脈與之周圍的股靜脈與肌肉。將棉線由股動脈下方穿過後,於股動脈近心端用棉線打鬆活結並用止血鉗往近心端上提棉線,且於股動脈離心端用棉線打緊活結。用顯微剪刀於股動脈兩端中剪出一個小洞,再將動脈插管由孔洞插入至股動脈近心端,並用兩端的棉線固定動脈插管,且蓋上浸泡過生理食鹽水的紗布於切口上,並再確認血管有無回血。最後在動脈插管後端接上傳感器與訊號放大器,並打開機器與軟體,即可及時監控大鼠動脈舒張壓與收縮壓。
- 解剖:一手持鑷子,另一手持剪刀,將大鼠腹部皮膚與肌肉上提並剪出T字形路徑,並從腹腔往胸腔上方剪去肋骨,即可看到大鼠的心臟。
- 灌流:首先將灌流用的幫浦系統抽取生理食鹽水,讓幫浦中充滿生理食鹽水,並確認針頭進入左心室的主動脈後,灌流約200ml生理食鹽水約5分鐘。接下來,換灌流250 ml 4 %多聚甲醛約7分鐘,之後再灌流250 ml 4 %多聚甲醛的10%蔗糖溶液約7分鐘,最後將針頭取出並且把剩餘在管內的溶液吐回血清瓶。
- 組織處理:從灌流完成的大鼠中,取下我們要的組織(中樞神經)並將之浸泡於30%蔗糖磷酸鹽緩衝生理食鹽水保存,再放置於4°C冰箱中。
三、結果
(一)老師演示
 |
| (圖一)大鼠麻醉後被固定於手術台上 |
1. 氣管插管
 |
| (圖二)用剪刀剪開大鼠頸部皮膚 |
 |
| (圖三)剪破大鼠頸部皮膚 |
 |
| (圖四)撥開氣管周圍的肌肉並找到氣管 |
 |
| (圖五)在氣管兩端剪一個小洞 |
 |
| (圖六)將氣插管插入近肺端的氣管 |
 |
| (圖七)氣管插管完成 |
 |
| (圖八)蓋上濕紗布 |
2. 動脈插管
 |
| (圖九)剪開左下腹 |
 |
| (圖十)股動脈與股靜脈 |
 |
| (圖十一)股動脈分離 |
 |
| (圖十二)在股動脈上剪出小洞 |
 |
| (圖十三)動脈插管插入近心端動脈 |
 |
| (圖十四)動脈插管完成 |
3. 生理測量
 |
| (圖十五)動脈插管接上傳感器 |
 |
| (圖十六)氣插管接上呼吸頭 |
 |
| (圖十七)溫度控制器 |
 |
| (圖十八)生理測量圖:呼吸流量(上)、動脈血壓(中)、體溫(下) |
4. 解剖與灌流
 |
| (圖十九)剖開腹腔 |
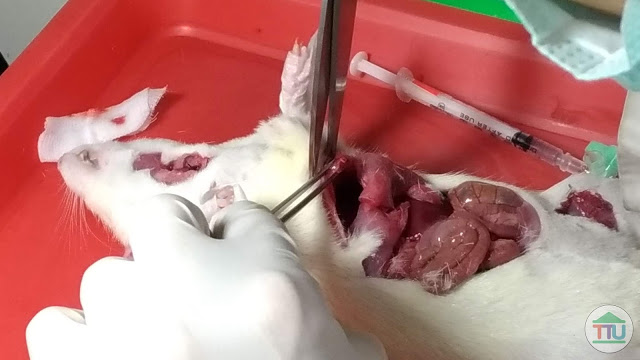 |
| (圖二十)剖開胸腔 |
 |
| (圖二十一)找到心臟並將針插入 |
 |
| (圖二十二)止血鉗夾住心臟與針並開始灌流 |
 |
| (圖二十三)取下橫膈膜 |
 |
| (圖二十四)灌流完成 |
5. 組織處理
 |
| (圖二十五)剖開背部 |
 |
| (圖二十六)分離背肌 |
 |
| (圖二十七)小腦與脊髓 |
 |
| (圖二十八)大腦 |
 |
| (圖二十九)中樞神經分離 |
 |
| (圖三十)中樞神經腹面 |
 |
| (圖三十一)中樞神經背面並將之浸泡於保存劑中於冰箱保存 |
(二)自己操作
有成功找到氣管並剪小洞將氣插管插入,但忘記拍照記錄,也有成功找在大鼠左下腹找到股動脈與股靜脈,並將之分離,但最後動脈插管尚未插入成功。最後直接剖腹與胸,開始灌流。 |
| (圖三十二)大鼠 |
 |
| (圖三十三)切開大鼠左下腹並找到股動脈與股靜脈 |
 |
| (圖三十四)股動脈與之周圍肌肉分離 |
四、心得
一開始的麻醉就花了不少時間,明明是要給予腹腔注射,但卻變成皮下注射,可能是針頭還不夠垂直,所以大鼠右下腹腫了一包,然而只好等個數分鐘在補打麻醉藥。開始解剖後,很快地就找到氣管,氣管也十分有彈性,氣插管也很順利插進氣管中,但股動脈埋的比較深,且周圍肌肉與血管較多,所以找尋與分離花了不少時間,然而試著將動脈插管插入動脈都無功而返,只好直接做灌流的動作。

留言
張貼留言